Thu hồi toàn quốc lô thuốc Bronzoni trị ho, sát trùng đường hô hấp
00:01 | Thứ bảy, 21/11/2020 0Cục quản lý Dược (Bộ Y tế) vừa có thông báo thu hồi thuốc viên nang mềm Bronzoni, số đăng ký: VD-19598-13, số lô: 915101, ngày sản xuất: 28/5/2019, hạn dùng: 28/5/2022 do Công ty cổ phần sản xuất - thương mại dược phẩm Đông Nam sản xuất tại:
Các cơ sở kinh doanh, cơ sở khám bệnh, chữa bệnh trên địa bàn thành phố Hà Nội; Các cơ sở kinh doanh, cơ sở khám bệnh, chữa bệnh không nằm trên địa bàn thành phố Hà Nội đã mua lô thuốc trên do Công ty cổ phần VIC Pharma Hà Nội cung cấp.
Lô thuốc bị thu hồi không đạt tiêu chuẩn chất lượng về chỉ tiêu định tính tinh dầu Tần (vết Rf 0,7), vi phạm mức độ 3.
Ảnh minh họa
Cục yêu cầu Công ty Đông Nam phải phối hợp với các cơ sở sản xuất thuốc trong thời hạn 2 ngày kể từ ngày 20.11 gửi thông báo thu hồi tới các cơ sở bán buôn, bán lẻ, sử dụng thuốc viên nang mềm Bronzoni, số đăng ký: VD-19598-13, số lô: 915101, ngày sản xuất: 28/5/2019, hạn dùng: 28/5/2022, và tiến hành thu hồi toàn bộ lô thuốc không đạt tiêu chuẩn chất lượng nêu trên trên địa bàn thành phố Hà Nội và các cơ sở kinh doanh sử dụng thuốc do Công ty cổ phần VIC Pharma Hà Nội cung cấp.
Gửi báo cáo thu hồi về Cục quản lý Dược, Sở Y tế Hà Nội trong thời hạn 33 ngày kể từ ngày 20.11.
Đồng thời, báo cáo tình hình sản xuất (thời gian, số lượng sản xuất), phân phối (tên, địa chỉ các cơ sở kinh doanh đã mua thuốc, số lượng cung cấp) lô thuốc Bronzoni, số đăng ký: VD-19598-13, số lô: 915101, ngày sản xuất: 28/5/2019, hạn dùng: 28/5/2022 về Cục quản lý Dược, Viện kiểm nghiệm thuốc trung ương, Viện kiểm nghiệm thuốc TP.HCM trong thời hạn 7 ngày kể từ ngày 20.11.
Công ty Đông Nam phải phối hợp với cơ quan kiểm tra chất lượng, cơ quan kiểm nghiệm thuốc nhà nước tiến hành lấy mẫu bổ sung tại ít nhất một cơ sở bán buôn khác không thuộc địa bàn thành phố hà Nội và một cơ sở bán buôn đã cung cấp thuốc cho Công ty cổ phần VIC Pharma Hà Nội.
Yêu cầu Công ty cổ phần VIC Pharma Hà Nội tiến hành thu hồi toàn bộ số thuốc Bronzoni, số đăng ký: VD-19598-13, số lô: 915101, ngày sản xuất: 28/5/2019, hạn dùng: 28/5/2022 không đạt tiêu chuẩn chất lượng nêu trên tại công ty và các cơ sở kinh doanh, sử dụng đã được công ty phân phối; báo cáo kết quả về Cục quản lý Dược, Sở Y tế Hà Nội trong thời hạn 33 ngày kể từ ngày 20.11.
Viện kiểm nghiệm thuốc trung ương và Viện kiểm nghiệm thuốc TP.HCM ưu tiên tiến hành kiểm tra chất lượng đối với chỉ tiêu định tính tinh dầu Tần (vết Rf 0,7) của các mẫu lấy bổ sung đối với thuốc viên nang mềm Bronzoni, số đăng ký: VD-19598-13, số lô: 915101, ngày sản xuất: 28/5/2019, hạn dùng: 28/5/2022 do Công ty Đông Nam sản xuất, báo cáo kết quả về Cục.
Sở Y tế Hà Nội công bố thông tin thu hồi lô thuốc Bronzoni nói trên trên trang thông tin điện tử của sở. Kiểm tra và giám sát Công ty Đông Nam và Công ty VIC Pharma Hà Nội thực hiện thu hồi trên địa bàn lô thuốc Bronzoni nói trên.
Sở Y tế TP.HCM kiểm tra và giám sát Công ty Đông Nam thực hiện việc báo cáo tình hình sản xuất, phân phối và gửi mẫu bổ sung để kiểm tra chất lượng lô thuốc Bronzoni, số đăng ký: VD-19598-13, số lô: 915101, ngày sản xuất: 28/5/2019, hạn dùng: 28/5/2022 nêu trên theo quy định.
Thuốc Bronzoni có chỉ định điều trị: Sát trùng đường hô hấp, làm dịu cơn đau họng; Trị các chứng ho…
Hữu Tiến
-
GS. Nguyễn Văn Tuấn: Thành công được định nghĩa từ những thất bại
-
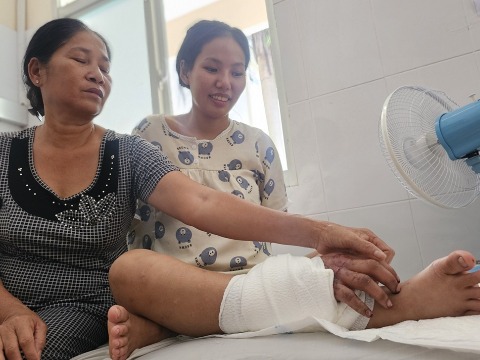 Kỳ tích: Ghép bàn tay vào chân cho cô gái 18 tuổi mang song thai để chờ ngày nối lại
Kỳ tích: Ghép bàn tay vào chân cho cô gái 18 tuổi mang song thai để chờ ngày nối lại
-
 Làng gốm 500 năm tuổi ở Hội An được vinh danh là điểm du lịch cộng đồng tốt nhất năm 2025
Làng gốm 500 năm tuổi ở Hội An được vinh danh là điểm du lịch cộng đồng tốt nhất năm 2025
-
Bước chân Di sản – giải chạy cộng đồng gây quỹ bảo tồn làng nghề Việt
- Tác động của dự án du lịch cáp treo lên “huyệt đạo thiêng” núi Nưa
- Đập bỏ 3 biệt thự cổ tại khu đất Lý Thái Tổ: Khác biệt từ hai kết quả đánh giá biệt thự
- Ngôi nhà sàn của bác sĩ Yersin ở Nam Tây Nguyên
- Bài học về tư duy “xoá trắng” trong quy hoạch đô thị
- Sài Gòn tình nghĩa truyền đời
- Cá trứ danh miền nước dữ sông Đà
- AI tạo đột phá gì trong quản lý đô thị?
- Chuyên gia Phan Chánh Dưỡng - Từ công dân gương mẫu đến nạn nhân cưỡng chế sai
- Gây mất rừng phải bồi hoàn
- Ngắm phối cảnh “siêu dự án” thể thao lớn nhất miền Nam
- Hạ tầng 13.200 tỷ đồng mở lối, bất động sản Cần Giờ trước bước ngoặt lớn
- Metro số 2 Bến Thành – Tham Lương: mảnh ghép lớn trong mạng lưới đường sắt đô thị TP.HCM
- Tái thiết đô thị trong kỷ nguyên mới: Từ mở rộng diện tích sang kiến tạo chất lượng sống
- Khu cảng Nhà Rồng – Khánh Hội và bài toán 'hạ tầng mềm' ven sông Sài Gòn
- Nguyễn Phan Quế Mai: Một đời gió bụi và những khát vọng văn chương


